Cân bằng phương trình điều chế từ H2S, O2 ra H2O, SO2
Phương trình H2S + O2 → SO2 + H2O xảy ra khi đốt khí H2S trong không khí ở nhiệt độ cao và dư oxi. Dưới đây là chi tiết phản ứng H2S ra SO2. Cùng Studytienganh tìm hiểu trong bài viết này nhé!
1. Phương trình phản ứng H2S ra SO2
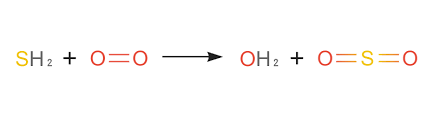
Phương trình phản ứng H2S ra SO2
- Phương trình cân bằng:
|
2H2S + 3O2 → 2SO2 + 2H2O |
- Điều kiện: Nhiệt độ cao, oxi dư
- Loại phản ứng: oxi hóa khử.
Lưu ý: Nếu đốt cháy khí H2S ở nhiệt độ không cao hoặc thiếu oxi, khí H2S bị oxi hóa thành lưu tự do, màu vàng
2. Tính chất hóa học của H2S
Phân tử H2S
Khái niệm: H2S là Hydrogen sulfide được sử dụng trong sản xuất bột giấy và giấy (chất phân hủy), trong xưởng thuộc da và quặng sulfua. Hầu hết hydro sunfua do con người tạo ra được sản xuất như một sản phẩm phụ của công nghiệp. Hydrogen sulfide là một loại khí độc, không màu, dễ cháy, có mùi trứng thối. Nó hòa tan trong nước và dung môi hữu cơ và sẽ ăn mòn kim loại.
Tính chất vật lý của H2S
-
Điểm sôi của nước và H2S lần lượt là 100 o C và -60 o C.
-
H2S đặc hơn hoặc nặng hơn không khí một chút nhưng khá hòa tan trong nước.
-
H2S là một loại khí độc, không màu, có thể dẫn đến chóng mặt, đau đầu.
-
Nó có mùi trứng thối đặc trưng.
-
H2S là một loại khí dễ cháy.
Tính chất hóa học của H2S
-
Hỗn hợp không khí và H2S có thể gây nổ.
-
Oxy và H2S bắt lửa với ngọn lửa màu xanh để tạo ra sulfur dioxide (SO2 ) và nước.
-
H2S đóng vai trò là chất khử và chủ yếu là khi có mặt của bazơ tạo ra SH – .
-
Với sự có mặt của chất xúc tác hoặc ở nhiệt độ cao hơn, sulfur dioxide phản ứng với hydro sulfua để tạo ra nước và lưu huỳnh nguyên tố. Phản ứng này là một phương pháp công nghiệp thiết yếu để loại bỏ H2S.
-
Nó có tính axit trong tự nhiên khi nó làm giấy quỳ tím chuyển sang màu đỏ.
-
H2S là chất rắn màu sẫm có thể phản ứng với các ion kim loại để tạo thành sunfua kim loại không hòa tan.
-
Ở áp suất lớn hơn 90 GPa, H2S chuyển thành chất dẫn kim loại.
-
Khi đun nóng, H2S bị phân hủy. Nó thường phân hủy thành hydro và lưu huỳnh.
-
H2S cũng có tính chất khử, cho phép nó thay đổi màu sắc của chất.

H2S là chất khí rất độc
Sản xuất hydro sunfua
Phương pháp phổ biến nhất có thể được sử dụng để thu được hydro sunfua là tách nó ra khỏi khí chua, là những khí tự nhiên có hàm lượng H2S cao.
H2S cũng có thể được sản xuất bằng cách sử dụng lưu huỳnh nguyên tố nóng chảy để xử lý hydro ở khoảng 450 °C. Trong đó, hydrocacbon đóng vai trò là nguồn hydro trong quá trình này.
H2S chủ yếu thu được dưới dạng chất thải khi vi khuẩn khử sulfat oxy hóa các hợp chất hữu cơ hoặc hydro để tạo ra năng lượng có thể sử dụng được trong điều kiện oxy thấp.
3. Bài tập trắc nghiệm có đáp án
Câu 1: H2S được điều chế từ chất nào sau đây
A. FeS
B. SO2
C. SO3
D. Không chất nào ở trên.
Đáp án: A
Câu 2: H2S được giải phóng bằng cách đun nóng sunfua và HSO3.
A. Đúng
B. Sai
Đáp án: A
Câu 3: Để điều chế hiđro sunfua, tỷ lệ sáp parafin và lưu huỳnh phải là
A. 3:1
B. 2:1
C. 1:2
D. 1:4
Đáp án: B
Câu 4: Phát Biểu Nào Dưới Đây Là Sai?
A. H2S là khí không mùi
B. H2S nguy hiểm với sức khỏe con người
C. H2S là khí dễ cháy
D. H2S ăn mòn kim loại
Đáp án: A
Qua bài viết này, studytienganh đã hoàn thành cân bằng phương trình hóa học h2s ra so2. Chúc các bạn học tập thật tốt và đừng quên theo dõi studytienganh để cập nhật những thông tin mới nhất.