[Lời giải] Khí amoniac làm giấy quỳ tím ẩm chuyển màu gì? Lý thuyết Amoniac (Hóa 11)
Có lẽ có nhiều bạn thắc mắc rằng: Khí amoniac làm giấy quỳ tím ẩm chuyển màu gì đúng không? Vậy trong bài viết này, các bạn hãy cùng Studytienganh.vn tìm hiểu câu trả lời cho câu hỏi này nhé!
1. Khí amoniac làm giấy quỳ tím ẩm chuyển màu gì?
Câu hỏi trắc nghiệm: Khí amoniac làm giấy quỳ tím ẩm
A. chuyển thành màu đỏ.
B. chuyển thành màu xanh.
C. không đổi màu.
D. mất màu.
Đáp án: B
Khí amoniac có công thức phân tử là NH3. NH3 là chất có tính bazo, do đó khi amoniac tác dụng với giấy quỳ tím ẩm thì giấy quỳ tím ẩm sẽ chuyển sang màu xanh.

( Hình ảnh khí amoniac làm quỳ tím ẩm chuyển màu )
Công thức hóa học là: NH3 + H2O → NH4OH
Tuy amoniac sẽ làm quỳ tím ẩm chuyển thành màu xanh nhưng khi cho quỳ tím khô vào bình đựng khí amoniac thì giấy quỳ tím không chuyển màu đâu nhé!
2. Lý thuyết amoniac Hóa 11
Amoniac là gì?
Amoniac là một hợp chất vô cơ có thể từ xác thối rữa hoặc từ hoạt động bài tiết mà có.
- Công thức phân tử của Amoniac: NH3.
- Phân tử khối của NH3: 17,0304 g/mol.
- Amoniac là chất khí không màu và có mùi khai.
CẤU TẠO
Nguyên lý tạo nên NH3 là từ nguyên tử nitơ hình thành với ba nguyên tử hidro bằng ba liên kết cộng hóa trị, do có 3 electron tự do.
Phân tử NH3 có cấu tạo hình chóp, với nguyên tử nitơ ở đỉnh và đáy là một tam giác ở đó đỉnh là ba nguyên tử hiđro.
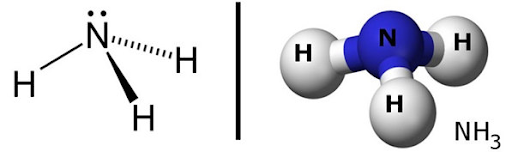
( Hình ảnh cấu tạo phân tử NH3 )
Ba liên kết N-H trong NH3 đều là liên kết cộng hóa trị có cực, các cặp electron chung đều lệch về phía nguyên tử nitơ.
Từ đó có thể thấy, NH3- amoniac là phân tử có cực.
TÍNH CHẤT VẬT LÍ
Amoniac - NH3 là chất khí không màu, có mùi khai và sốc, NH3 nhẹ hơn không khí và tan tốt trong nước.
TÍNH CHẤT HÓA HỌC
+ Tính bazo yếu
Do có cặp electron tự do nên NH3 dễ nhận H+, thể hiện tính bazơ yếu, tức là tác dụng với nước tạo dung dịch làm quỳ tím hóa xanh, tác dụng với axit và tác dụng với dung dịch muối.
- Tác dụng với nước:
Công thức hóa học: NH3 + H2O ↔ NH4+ + OH-
Từ đó thấy, dung dịch NH3 là một dung dịch bazơ yếu.
- Tác dụng với dung dịch muối:
Công thức hóa học: AlCl3 + 3NH3 + 3H2O → Al(OH)3↓ + 3NH4Cl
Trong công thức trên, Al(OH)3 không tan được trong dung dịch NH3.
- Tác dụng với axit tạo muối amoni:
Công thức hóa học: NH3 + HCl → NH4Cl (amoniac clorua)
+ Tính khử
Trong NH3, Nito có mức oxi hóa thấp nhất là (-3) nên NH3 thể hiện tính khử mạnh như tác dụng với oxi, clo hay một số oxit kim loại.
- Tác dụng với Oxi:
Công thức: 4NH3 + 3O2 ( tác dụng với nhiệt độ) → 2N2 + 6H2O
Nếu có Pt là xúc tác, thì thu được khí NO: 4NH3 + 5O2 ( tác dụng với nhiệt độ) → 4NO + 6H2O
- Tác dụng với Clo:
Công thức hóa học: 2NH3 + 3Cl2 → N2 + 6HCl
Từ đó thấy, NH3 kết hợp ngay với HCl vừa sinh ra tạo khói trắng NH4Cl.
- Tác dụng với oxit kim loại:
Công thức hóa học: 2NH3 + 3CuO (td với nhiệt độ) → 3Cu + N2 + 3H2O
ĐIỀU CHẾ
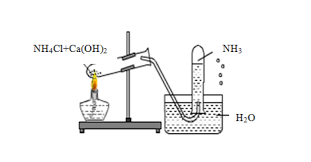
( Hình ảnh điều chế khí amoniac )
1. Trong phòng thí nghiệm
NH3 - amoniac được điều chế bằng cách cho muối amoniac tác dụng với chất kiềm khi đun nóng nhẹ. Người ta cũng có thể đun nóng dung dịch amoniac đặc để cho ra nhanh một lượng nhỏ khí amoniac.
2. Trong công nghiệp
Trong công nghiệp, Amoniac - NH3 được tổng hợp từ khí N2 và khí H2 theo phản ứng sau:
Công thức hóa học: N2 (k) + 3H2(k) ⇔ 2NH3 (k); ∆H = -92 kJ
Trên đây là câu trả lời cho câu hỏi khí amoniac làm giấy quỳ tím ẩm chuyển thành màu gì? và còn có cả những kiến thức hóa học về amoniac nữa đấy. Chúc các bạn tìm hiểu được nhiều kiến thức mới mẻ nhé!